SPORT EN PROTIDES in samenwerking met ATLET
Samenvatten'
Eiwitten vormen een heterogene chemische familie en worden beschouwd als biomoleculen van primair belang:
Kwantitatief vertegenwoordigen eiwitten 55 tot 85% van het drooggewicht. Ze zijn het tweede meest voorkomende element in het lichaam na water.
Kwalitatief hebben ze een structurele maar ook een vitale functionele rol.
Behalve in uitzonderlijke gevallen (langdurig vasten, onvoldoende glycogeenreserves, enz.), dragen eiwitten niet significant bij tot het voorzien in de energiebehoefte.
Onze behoeften zijn erg belangrijk op het gebied van eiwitten. Onze organisatie produceert bijna 100 verschillende soorten!
Alle eiwitten zijn opgebouwd uit 20 verschillende aminozuren.
Onder hen zijn er 8 essentiële aminozuren (EAA): het menselijk lichaam weet niet hoe ze ze moeten produceren. Het voedsel moet ze dus voorzien en bovendien bij dezelfde maaltijd. Want als het lichaam slechts één van deze 8 EAA's mist om een van zijn eiwitten te produceren, stopt de productie van het eiwit en weet het lichaam niet hoe het de andere 7 opzij moet zetten totdat de 8e arriveert.
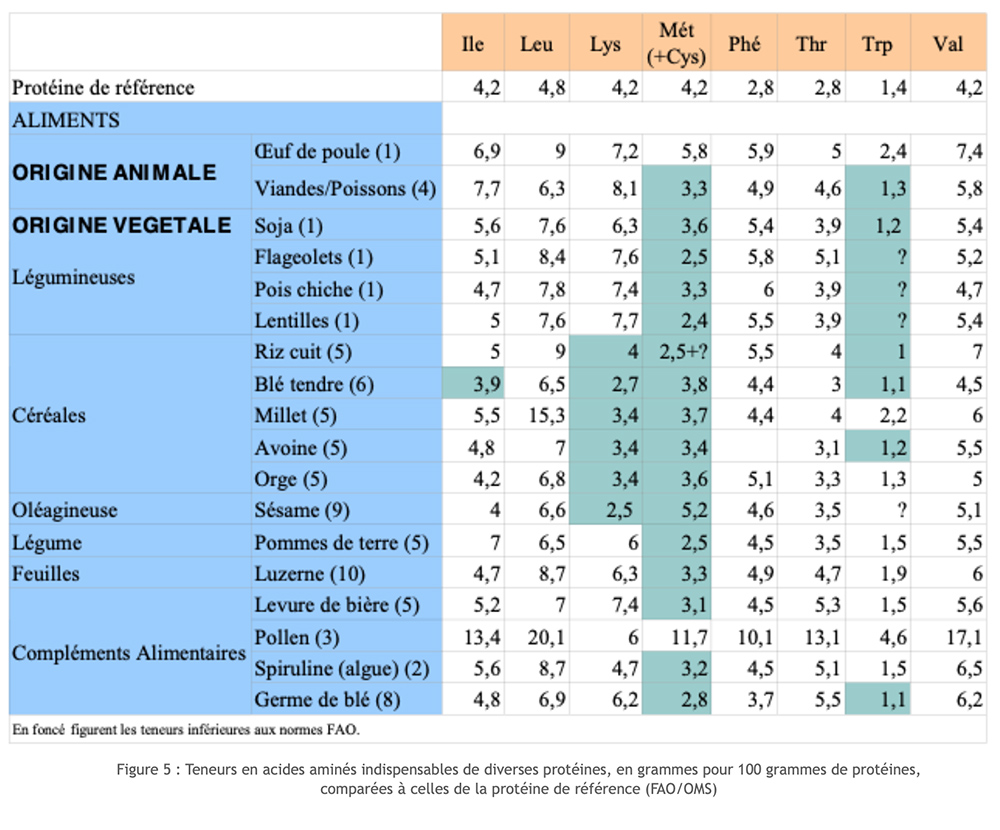
Dierlijke eiwitten leveren al deze 8 EAA's, wat niet het geval is met plantaardige eiwitten, die een tekort hebben aan een van de 8 EAA's. Vegetariërs moeten daarom bij dezelfde maaltijd zowel granen (tarwe, maïs, rijst, enz.) met weinig lysine als peulvruchten (linzen, kikkererwten, enz.) met weinig methionine eten.
Eiwitsynthese is essentieel voor ontwikkeling, groei, maar ook voor het behoud van de lichaamsmassa. Als koolhydraten de essentiële bron van energie zijn, verhoogt regelmatige lichaamsbeweging de dagelijkse behoefte aan stikstofverbindingen aanzienlijk. Onder zeer specifieke omstandigheden is het waarschijnlijk dat bepaalde aminozuren worden geoxideerd om op zich zelf energiesubstraten te vormen. Alle eiwitten die in het lichaam aanwezig zijn, spelen echter een specifieke functionele rol en er zijn geen opgeslagen en opgeslagen aminozuren zoals koolhydraten of lipiden. Indien nodig zijn het daarom de aminozuren die zijn afgeleid van structurele of functionele eiwitten die zullen worden gebruikt, die waarschijnlijk de werking van het organisme zullen beïnvloeden.
Dus, bij afwezigheid van eiwitinname, kan het lichaam zichzelf kannibaliseren en zichzelf verteren!
De afwezigheid van eiwitten verplicht het lichaam om ze uit zijn "reserves" te halen: het smelten van de spieren (inclusief het hart) en vervolgens van de ingewanden (darm, lever, enz.) is dan onvermijdelijk!
Het aanspreken van de reserves leidt tot tekorten: het immuunsysteem verzwakt, de spijsvertering en de doorvoer vertragen, de genezing is slecht, de huid veroudert...
Zoals vaak het geval is, zijn de variaties in het eiwitmetabolisme nauw verbonden met het type sport dat wordt beoefend, en de problemen die zich voordoen zullen heel verschillend zijn naargelang de beschouwde sportdiscipline uithoudingsvermogen of kracht is. In het zeer brede scala dat gaat van korte en zeer intensieve oefeningen (anaërobe oefeningen van het explosieve type) tot langdurige oefeningen van het duurzame type, zijn de reacties van het eiwitmetabolisme echter kwalitatief vergelijkbaar, wat gepaard gaat met een daling van de eiwitsynthese en toename van degradatie tijdens activiteit, en omgekeerd tijdens herstel...
Herinneringen aan lessen biochemie …
Eiwitten vormen een heterogene chemische familie en worden beschouwd als biomoleculen van primair belang:
- kwantitatief vertegenwoordigen eiwitten 55 tot 85% van het droge gewicht. Ze zijn het tweede meest voorkomende element in het lichaam na water.
- kwalitatief hebben ze een structurele rol, maar ook een essentiële functionele rol.
Behalve in uitzonderlijke gevallen (langdurig vasten, diabetes, etc.) dragen eiwitten niet significant bij aan het voorzien in de energiebehoefte.
Ze hebben een rol van mechanische ondersteuning en weefselondersteuning, bijvoorbeeld collageen, het meest voorkomende eiwit in het lichaam; op cellulair niveau zijn cytoskeleteiwitten (actine, tubuline) verantwoordelijk voor de celvorm.
Ze hebben de rol van biochemische katalysator, het geval van enzymen zonder welke bijna alle chemische reacties in het lichaam onmogelijk zouden zijn; rol van bloeddrager, albumine (het belangrijkste plasma-eiwit, draagt bij tot het transport van vrije vetzuren of bepaalde vitamines) of hemoglobine (bevindt zich in de rode bloedcellen, maakt het transport van zuurstof en koolstofdioxide mogelijk) ; rol van membraantransporteur, eiwitten controleren kwantitatief en kwalitatief de uitwisselingen tussen de cel en de extracellulaire omgeving, de specifieke transporters van glucose; rol van chemische mediator zoals peptidehormonen zoals insuline en glucagon; rol van membraanreceptor; rol bij het handhaven van de integriteit van het lichaam, immunoglobulinen (antilichamen); rol van beweging, de contractiele eiwitten van de spieren (actine en myosine).
Eiwitten zijn organische verbindingen die bestaan uit koolstof (C), waterstof (H), zuurstof (O) en stikstof (N) waaraan soms zwavel (S) wordt toegevoegd. Hun monomere structuur is aminozuur. Afhankelijk van het belang van de polymerisatie en de samenstelling zijn er verschillende soorten eiwitten te onderscheiden:
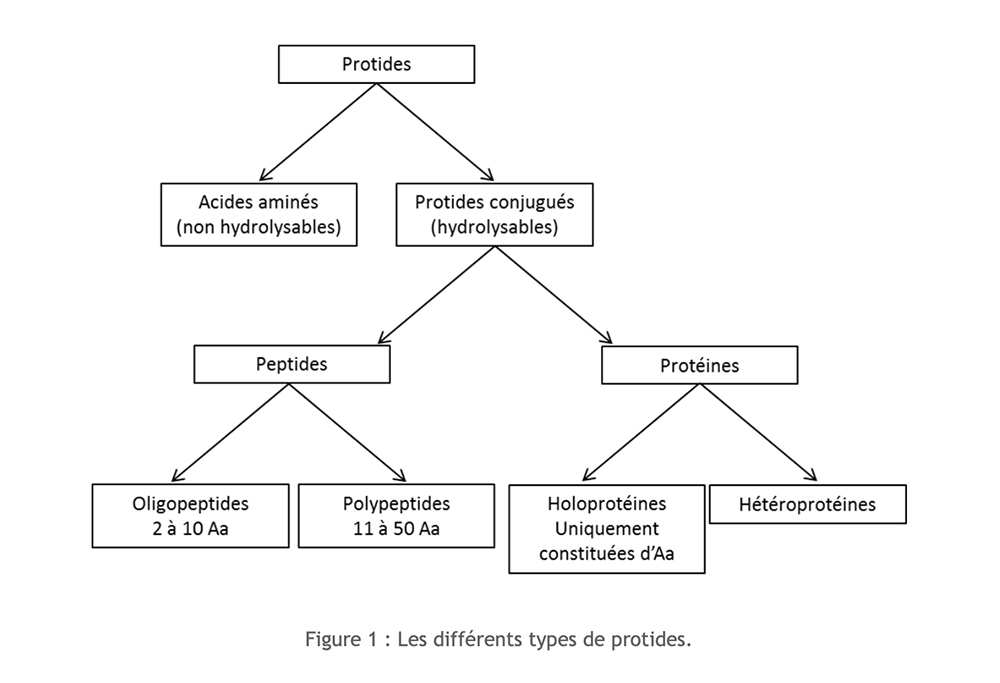
Aminozuren
Aminozuren hebben een gemeenschappelijke moleculaire structuur. Het zijn stikstofverbindingen.
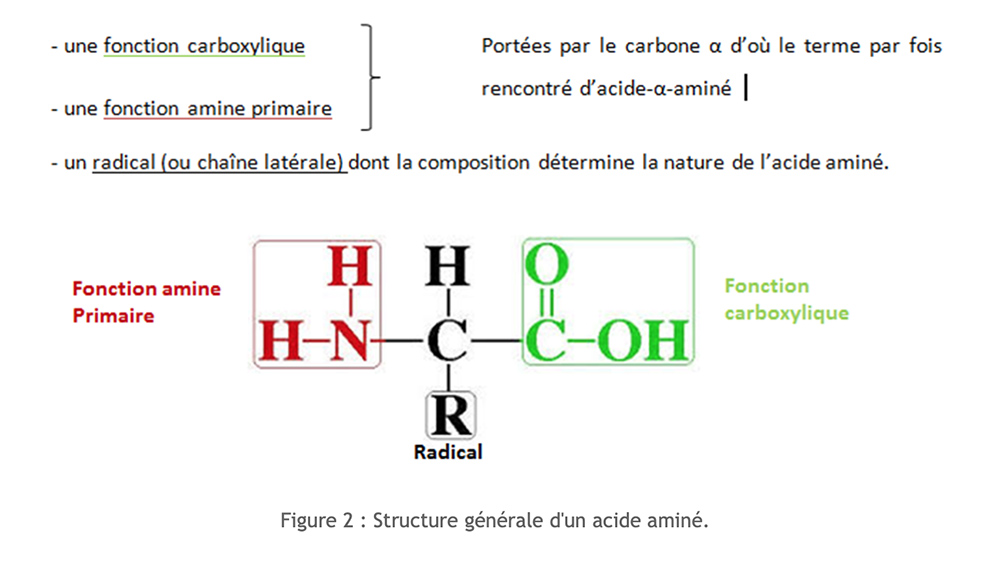
Er worden meer dan 250 verschillende aminozuren vermeld. Al onze eiwitten zijn echter gemaakt van een groep van 20 aminozuren, diestandaard aminozuren.
We kunnen deze aminozuren classificeren volgens de aard van hun zijketen. Om het schrijven van de aminozuren te vergemakkelijken, wordt een code van drie letters of een code met één letter gebruikt.
De verschillende aminozuren
We kunnen acht essentiële aminozuren opnoemen bij volwassenen (Val, Leu, Ile, Thr, Met, Lys, Phe en Trp) plus een negende bij kinderen (His). Deze aminozuren moeten absoluut in de voeding aanwezig zijn.
- blauweregen (Gly of G).
- alanine (Ala of A), aminozuur dat veel voorkomt in eiwitten.
- de vallei (Val of V).
- Leucine (Leu of L) en isoleucine (Ile of I) die niet door het lichaam kunnen worden gesynthetiseerd, ze maken daarom deel uit van de essentiële aminozuren.
- serine (Ser of S).
- Threonine (Thr of T), wat een essentieel aminozuur is.
- cysteïne (Cys of C) draagt bij tot de stabilisatie van de tertiaire structuur van eiwitten dankzij de vorming van disulfidebruggen. Cysteïne is ook de voorloper van taurine.
- methionine (Met of M) dat deel uitmaakt van de essentiële aminozuren.
- Asparaginezuur (Asp of D) en deglutaminezuur (Glu of E). Deze aminozuren komen veel voor in eiwitten. Als vrije aminozuren spelen ze een belangrijke rol in het stikstofmetabolisme. Glutaminezuur dient ook als een voorloper voor de vorming van γ-aminoboterzuur (GABA), een bemiddelaar van het centrale zenuwstelsel.
- asparagine (Asn of N) en glutamine (Gln of Q); ze spelen een belangrijke rol in het stikstofmetabolisme.
- Lysine (Lys of K) is een van de essentiële aminozuren (het wordt met name gevonden in collageen).
- L'arginine (Arg of R) speelt een belangrijke rol in de ureumcyclus en neemt deel aan de vorming van creatine.
- histidine (Hi of H) wordt bij kinderen als een essentieel aminozuur beschouwd.
- fenylalanine (Phe of F) is een van de essentiële aminozuren. Zoals de naam al doet vermoeden, is de structuur die van alanine gesubstitueerd door een fenylgroep, waardoor een hydrofobe radicaal wordt gevormd. De hydroxylering ervan geeft tyrosine (Tyr of Y). Deze twee aminozuren zijn belangrijk omdat ze dienen als voorlopers voor de biosynthese van catecholamines (de meest voorkomende zijn adrenaline, noradrenaline en dopamine). Tyrosine neemt deel aan de vorming van schildklierhormonen.
- Tryptofaan (Trp of W) is een essentieel aminozuur. Het is een biosynthetische voorloper van serotonine en vitamine B3.
- Proline (Pro of P). Net als lysine heeft het de bijzonderheid dat het wordt gehydroxyleerd in collageen: hydroxyproline.
peptiden
Peptiden zijn het resultaat van de associatie van aminozuren. De binding is het resultaat van de condensatie tussen de carboxylfunctie (van de -koolstof) van een aminozuur en de aminefunctie (van de -koolstof) van een tweede aminozuur. Deze condensatie gaat gepaard met het vrijkomen van een watermolecuul.
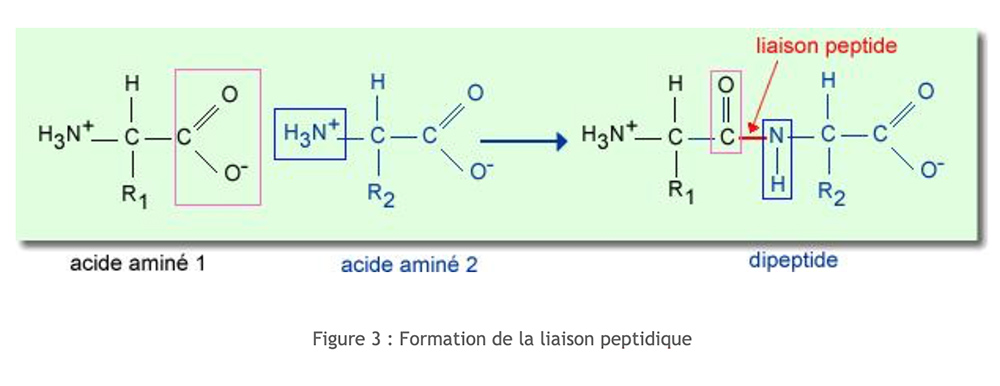
Deze elektronische opstelling induceert een stijve en vlakke peptidebinding. Hierdoor is er geen rotatie tussen C en N, wat de secundaire structuur van peptiden en eiwitten aanzienlijk beïnvloedt.
Voorbeelden van peptiden van biologisch belang
- glutathion: Dit tripeptide speelt een belangrijke rol op cellulair niveau door vrije radicalen te neutraliseren, vooral in rode bloedcellen. De volgorde is: γGlu-Cys-Gly.
- DHA: Dit peptide wordt gesynthetiseerd door de hypothalamus via zijn neurosecretoire neuronen. Het komt vrij ter hoogte van de achterste hypofyse in het bloed en heeft een hormonale rol: het stimuleert de heropname van water door de nieren.
Eiwitinname en lichaamsbeweging
Tegenwoordig is wetenschappelijk aangetoond dat het eiwitmetabolisme wordt beïnvloed door het beoefenen van lichaamsbeweging. We geven ze echter vaak een te grote rol; De voedingsrealiteit is meer gemeten.
Eiwitsynthese is essentieel voor ontwikkeling, groei, maar ook voor het behoud van de lichaamsmassa. Regelmatige sportbeoefening verhoogt de dagelijkse behoefte aan stikstofverbindingen aanzienlijk en in het bijzonder in zeer specifieke omstandigheden (uitputting van glycogeenvoorraden, sterke daling van de bloedsuikerspiegel, enz.). Wij slaan echter geen aminozuren op. Indien nodig zijn het daarom de aminozuren die zijn afgeleid van structurele of functionele eiwitten die zullen worden gebruikt, die waarschijnlijk de werking van het organisme zullen beïnvloeden.
Duursporten: behoefte aan aminozuuroxidatie en eiwit
Als de behoefte aan eiwitten de optimale hoeveelheid eiwitten vertegenwoordigt die nodig is om alle eiwitsynthese van het organisme te verzekeren, om de oxidatie van aminozuren en de relatieve verliezen als gevolg van de versnelling van de omzet van eiwitten te compenseren, kunnen we gemakkelijk concluderen dat de herhaling van uithoudingsoefeningen leidt tot een verhoging van de voedingsbehoeften van eiwitten en aminozuren. Langdurige lichaamsbeweging veroorzaakt significante veranderingen in het eiwitmetabolisme. Experimentele studies tonen aan dat dit soort duurtraining gepaard gaat met een drastische vermindering van de spiereiwitsyntheseprocessen. Daarom is er in de context van langdurige inspanning, als de toevoer van glucose onvoldoende is, een toename van eiwitafbraak met als doel de beschikbaarheid van aminozuren te vergroten die kunnen bijdragen aan gluconeogenese of de cyclus van Krebs kunnen binnengaan om energie te leveren in de vorm van ATP. eindelijk, de herstel van dit type oefening zal moeten worden overwogen gerichte eiwitinname.
De aminozuren die in ons lichaam beschikbaar zijn, hebben verschillende oorsprongen: ze zijn afkomstig van inname via de voeding, zijn het resultaat van endogene proteolyse of worden de novo in het lichaam gesynthetiseerd (voor niet-essentiële aminozuren). De beschikbaarheid van essentiële aminozuren hangt alleen af van de inname via de voeding en hun mate van afbraak.
Exclusief inspanning is er een perfecte balans tussen afbraak (proteolyse) en eiwitsynthese (proteosynthese).
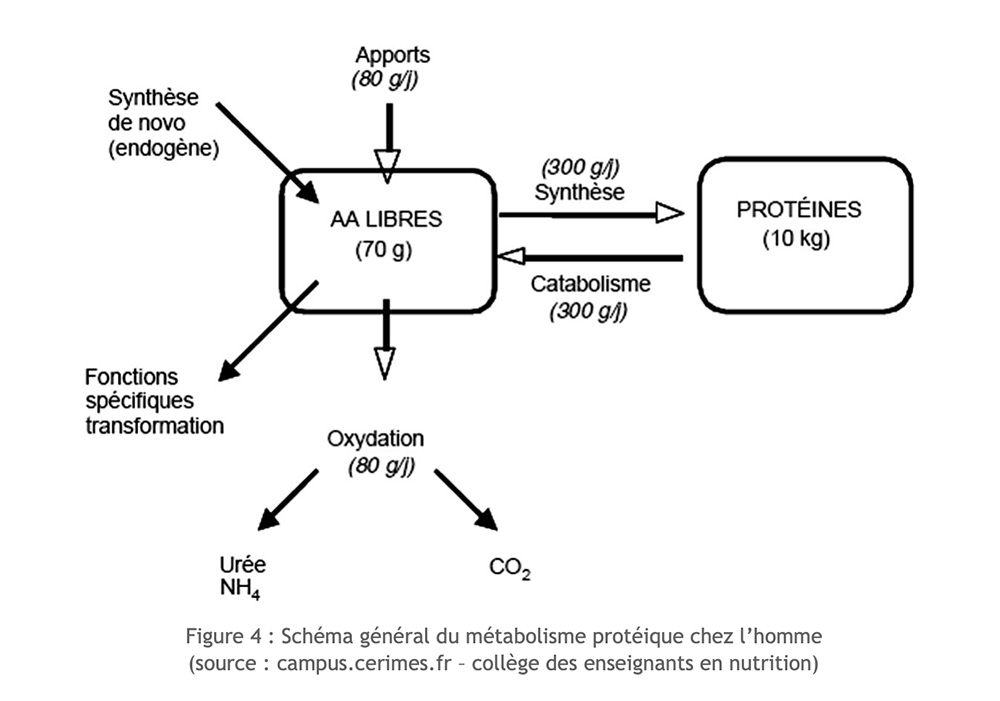
Maar in de context van langdurige inspanning wordt de stikstofopname verminderd, de eiwitsynthese kan de afbraak en spiermassaatrofieën niet compenseren. Bepaalde aminozuren kunnen dan worden beschouwd als echt bruikbare substraten voor het functioneren van de spieren. Ze worden oxidatief gebruikt. Er kunnen echter maar een paar aminozuren direct in de skeletspier worden geoxideerd: dit zijn in wezen vertakte of vertakte aminozuren (AAB: leucine, isoleucine, valine), en nog veel meer incidenteel aspartaat, asparagine en proline.
De eiwitten in onze voeding
Eiwitten uit voedsel komen nooit rechtstreeks in onze weefsels. Het moet worden "afgebroken" tot aminozuren of dipeptiden. Zodra de verteringsfase heeft plaatsgevonden, zijn de aminozuren die we via onze voedselopname binnenkrijgen niet te onderscheiden van de aminozuren die het gevolg zijn van de afbraak van lichaamseiwitten. Om zijn eigen eiwitten te ontwikkelen, zal ons lichaam putten uit de "gewone zak" waar alle beschikbare aminozuren worden gevonden (die uit voedsel en die welke het gevolg zijn van de vernietiging van lichaamseiwitten), op het moment "t". In een ideale situatie zou ons rantsoen optimale niveaus van aminozuren moeten bieden, met name de acht essentiële.
Dierlijke eiwitbronnen scoren redelijk goed op de schalen Biologische Waarde (BV) en Digestive Utilization Coefficient (DUC). Bij plantaardige eiwitten ligt dit anders. Inderdaad, of het nu granen of peulvruchten zijn, we ontdekken dat sommige van de essentiële aminozuren alleen worden geleverd in een veel te laag niveau (beperkende factor). Granen bevatten over het algemeen geen lysine; peulvruchten en soja hebben de beperkende factor methionine. Door de twee bronnen te koppelen, slagen we erin om een complete set essentiële AA, maar met een zekere verspilling! Bovendien, als deze keuze het mogelijk maakt om ernstige en chronische tekortkomingen voor een essentiële AA te voorkomen, garandeert dit niet het juiste verloop van alle metabolismes waarbij aminozuren betrokken zijn op de lange termijn. Deze functionele ontevredenheid komt met name voor bij de synthese van neurotransmitters, in het bijzonder die van serotonine dat afhankelijk is van tryptofaan, aminozuren die vaak beperkend zijn.
Daarbij komt nog het probleem dat verband houdt met de aminozuuropnamesystemen. Deze komen de cellen binnen via receptoreiwitten in celmembranen. Er zijn 4 families van receptoren voor 20 aminozuren. In feite vinden er concurrentieverschijnselen plaats. Het is dus niet voldoende om een aminozuur op het juiste niveau aan te bieden om er zeker van te zijn dat de resulterende processen correct plaatsvinden. Concurrerende aminozuren mogen niet met een te hoge snelheid worden gevonden, wat de assimilatie van de eerste zou belemmeren.
Uit de ruwe aminozuursamenstelling van een maaltijd kunnen we niet afleiden in hoeverre de toevoer van verschillende aminozuren optimaal wordt verzorgd aan elk van onze cellen.
Als je eiwitten eet, neem je stikstof op in je lichaam. Wanneer we overgaan tot het verschil van de twee (input minus output) krijgen we wat de "stikstofbalans" wordt genoemd. Een positieve stikstofbalans wordt geregistreerd wanneer de stikstofopname de som van de urinaire, fecale en zweetexcreties overschrijdt. Een positieve stikstofbalans is noodzakelijk om een adequaat niveau van synthese te verzekeren. Het is op basis van deze analysemethode dat de RNP (Voedingsaanbevelingen voor de bevolking) worden gedefinieerd, die verwijzen naar een in wezen kwantitatieve notie van behoeften, en voldoen aan de doelstellingen om tekortkomingen te voorkomen en de eiwitsynthese niet te beïnvloeden.
De aanbevelingen voor liefhebbers van duursporten zijn consensus: 1,2 tot 1,5 g/kg/dag.
Dus voor een persoon die 70 kg weegt, ligt de aanbeveling voor eiwitinname tussen: 84 g/dag tot 105 g/dag; dit staat gelijk aan bijvoorbeeld zeer grote hoeveelheden vlees: van 465 tot 580 g! Vandaar het belang van het consumeren van andere eiwitbronnen (granen, peulvruchten, enz.), of gerichte concentraten voor vroeg herstel. Nogmaals, we raden aan om een gevarieerde en evenwichtige dagelijkse voeding aan te nemen, aangepast aan het opleidingsniveau.
Bij atleten zijn de behoeften met betrekking tot functionele vernieuwing onder bepaalde omstandigheden verhoogd vanwege het katabolisme van eiwitten, dat met name de contractiele elementen van de spier beïnvloedt (vooral bij hardlopers, vanwege de schokgolf die een vernietigend effect uitoefent door herhaling zichzelf elke keer dat de voet op de grond drukt). Deze processen verhogen de verliezen en worden toegevoegd aan die welke overeenkomen met het energetisch gebruik van bepaalde aminozuren. Dientengevolge kan een verlies van de plasmaspiegel van de meeste aminozuren en een toename van de urinaire stikstofexcretie worden waargenomen na een voetgangertest van 100 km.
Maar pas op, het toegenomen gebruik van "niet-gerichte" eiwitsupplementen kan de behoefte aanzienlijk verhogen; inderdaad, de snelheid van synthese wordt bepaald door de beschikbaarheid van het minst aanwezige aminozuur in de weefsels. Dit betekent dat als de vertakte aminozuren hun niveau hebben zien dalen als reactie op inspanning, de syntheses die na inspanning worden uitgevoerd, evenredig zullen zijn met de resterende hoeveelheden leucine, isoleucine en valine.
Bepaalde aminozuren werken als moleculen die de eiwitsynthese kunnen stimuleren. Leucine is in staat om specifiek de eiwitsynthese in de spieren en de lever te stimuleren, zelfs onder ongunstige omstandigheden (zie: Buse MG, Reid M (1975): Leucine, een mogelijke regulator van eiwitomzetting in spieren. J Clin. Invest., 58 : 1250).
De inname van eiwitsupplementen die rijk zijn aan vertakte aminozuren, maakt het dus mogelijk om spierafbraak en de verslechtering van een aantal fysieke, psychologische en fysiologische parameters te voorkomen (Cf.: Degoutte F, Jouanel P & Coll (2006): Food beperking en prestatie, biochemische, psychologische en endocriene veranderingen bij judo atleten.Int. J. Sport Med., 27 (1): 9 – 18.).
Naast vertakte aminozuren lijken ons twee andere niet te verwaarlozen in het rantsoen van de atleet:
methionine (beperkende factor voor peulvruchten en soja):
De aanwezigheid van methionine (Met) op een optimaal niveau conditioneert de voortgang van een groot aantal reacties die ook worden bepaald door de mate van energie-inname. Zoals we hierboven hebben gezien, kan Met inderdaad bijdragen aan het leveren van energie aan de weefsels in een noodsituatie. Dit gebeurt via de Krebs-cyclus ten koste van andere Metabole interventies. Daarom leidt elke verlaging van de inname van Met via de voeding tot een vertraging van deze verschillende routes, in het bijzonder die van de gluconeogenese, en dit om het minimumniveau in de cellen te behouden. Verder wordt de omzetting van Met in cysteïne ter bevordering van de vorming van glutathion (deelname aan de anti-radicalen cascade) afgeremd ten gunste van de energievoorziening, of kan niet plaatsvinden.
Glutamine, Glycine en Aspartaat:
Ons energiekapitaal is gebaseerd op het DNA-molecuul dat de vorm heeft van een dubbele helix (een dubbele streng). RNA daarentegen is een enkelstrengs polymeer vergelijkbaar met DNA. DNA slaat genetische informatie op in de cel, terwijl RNA wordt gebruikt om coderende informatie buiten de celkern te verzenden en vervolgens eiwitten uit deze informatie te synthetiseren. De basen waaruit RNA bestaat, worden in kleine hoeveelheden geleverd door voedsel, het grootste deel komt eigenlijk van syntheses die in cellen worden uitgevoerd. Deze zijn gemaakt van aminozuren, waarvan sommige slechts in beperkte hoeveelheden verkrijgbaar zijn. Genetisch kapitaal en eiwitten zijn daarom sterk afhankelijk. De voorlopers zijn: glutamine, glycine en aspartaat. Glutamine is des te meer betrokken omdat het 2 stikstofmoleculen bevat. De beschikbaarheid ervan is daarom cruciaal in situaties waar snelle celvermeerdering essentieel is (immuunrespons, genezing, enz.). Hier blijkt de aanwezigheid van enzymatische cofactoren zoals zink, vitamine B9, B12 (uitsluitend uit dierlijke bronnen) en B6 bepalend te zijn voor het soepel verlopen van het syntheseproces.
Daarom zal elk tekort of onevenwicht in de inname van deze aminozuren, en in het bijzonder glutamine, het herstel, de reactie op activiteit, beïnvloeden.
Deze verschillende punten maken het erg complex om een ideale/optimale eiwitinname te definiëren. De aanbeveling, zoals hierboven gezien, houdt rekening met mogelijke functiestoornissen om de vangst zowel kwantitatief als kwalitatief aan te passen aan de diversiteit. De supplementen zijn slechts kleine aanpassingen van het rantsoen en bestaan uit goed verteerbare en doelgerichte peptiden. Ze mogen in geen geval een compensatie bieden voor bewezen voedingstekorten. Soms als overbodig beschouwd, lijkt het er echter op dat ze gepaard gaan met een verbetering van de gezondheidstoestand van de betrokken sporter.
Artikel geschreven voor onze partner Atlet door:
Caroline JOUCLA • Staatsgediplomeerde voedingsdeskundige-diëtiste • www.carolinejoucladieteticienne.com
